درک خطر آلودگی میکروبیولوژیک در اتاق تمیز دارویی
برای یک مدیر آگاه در آزمایشگاه میکروبیولوژی درک خطر آلودگی میکروبیولوژیک در اتاق تمیز دارویی همیشه در اولویت است.
به گزارش اندیشگران – استاندارد و ضمیمه مصوب در اتحادیه اروپا تحت نام EN 17141 برای درک خطر آلودگی میکروبی عرضه شده است.
در واقع اهمیت درک خطرات آلودگی میکروبی را با همین استاندارد و نقشه راه مشخص میکنند.
توانایی شناسایی دقیق میکروب جدا شده از محیط کنترل شده برای ارزیابی خطر محصولات دارویی واقعا حیاتی است.
چنین فرایندی در نهایت به سلامت بیماران و اطمینان از حذف یا کنترل این ارگانیسم منجر میشود و کاملا مهم است.
استاندارد جدید اروپایی EN 17141:2020 در 12 آگوست 2020 صادر شد.
این استاندارد جایگزین استانداردهای EN ISO 14698-1:2003 و EN ISO 14698-2:2003 می شود.
این استاندارد محیط تمیز کنترل شده را پوشش می دهد و به اتاق تمیز و مناطق کنترل شده مربوط میشود.
هدف این استاندارد ارائه راهنماییهای به روز و اطلاعات بیشتر در مورد بهترین عملکرد برای ایجاد و نشان دادن کنترل آلودگی میکروبیولوژیکی موجود در هوا و سطح در محیط های کنترل شده تمیز است.
این استاندارد تلاش دارد تا درک کامل و بهتری برای کاربران در استخراج یک سیستم کنترل میکروبیولوژیکی فراهم کند.
در صنایع تحت نظارت، این استاندارد جدید راهنمایی هایی را ارائه می دهد که با انتظارات مقامات نظارتی سازگار است.
درک درست از آلودگی میکروبیولوژیک
آلودگی میکروبیولوژیک اتاق تمیز یک خطر مهم است که اگر درک درستی از آن داشته باشیم قدم بلندی در مهار آن برداشته ایم.
برای ایجاد کنترل میکروبیولوژیکی، درک خطرات آلودگی مهم است.
ریسک یا خطر مربوط به آلودگی را میتوان ترکیبی از احتمال وقوع آسیب و شدت آن آسیب تعریف کرد.
این یکی از اهداف کلیدی استاندارد جدید است.
با در نظر گرفتن منابع آلودگی، احتمال انتقال و تأثیر آن بر کیفیت محصول و در نهایت سلامت بیمار، میتوان به درک درستی از خطر آلودگی دست یافت.
رویکرد ارائه شده بر اساس اصول مدیریت ریسک کیفیت QRM است.
یک رویکرد مدیریت ریسک کیفیت موثر میتواند با ارائه ابزاری فعال برای شناسایی و کنترل مسائل بالقوه کیفیت در طول تولید، کیفیت بالای محصول را برای بیمار تضمین کند.
استاندارد جدید الزامات کنترل آلودگی میکروبیولوژیکی و راهنمایی در مورد صلاحیت و تأیید این محیط ها را مشخص میکند.
این استاندارد مربوط به چندین کاربرد مختلف با کاربرد خاص برای داروسازی، بیوداروسازی، تجهیزات پزشکی و سایر صنایع است.
این صنایع از این محیطها مانند محیطهای علوم زیستی یا بیولوژیک (مراقبتهای بهداشتی و بیمارستانها) و غذا استفاده میکنند.
میکروب زنده و غیرزنده
توجه به این نکته مهم است که این استاندارد از نظر دامنه به آلودگی میکروبیولوژیکی زنده محدود می شود.
هرگونه ملاحظات مربوط به اندوتوکسین، پریون و آلودگی ویروسی در استاندارد تازه حذف نمیشود.
چندین ضمیمه وجود دارد که اطلاعات بیشتری در مورد کنترل آلودگی زیستی خاص برای کاربردهای خاص ارائه میدهد.
هنگامی که یک سیستم کنترل آلودگی ایجاد، اجرا و نگهداری می شود، باید شناسایی همه منابع آلودگی میکروبی و مسیرهای آلودگی را در نظر بگیرد.
ارزیابی خطر از این منابع و معرفی روش های کنترلی برای کاهش خطرات شناسایی شده را باید از ابتدا درست تعریف کرد.
در واقع بهتر است تا یک برنامه نظارتی برای کنترل منابع شناسایی شده وجود داشته باشد.
برای جلوگیری از آلودگی و ایجاد کنترل میکروبیولوژیکی، درک خطرات آلودگی مهم است.
این امر با در نظر گرفتن منابع و احتمال انتقال و اینکه چگونه این امر بر کیفیت محصول و بیمار یا مصرف کننده تأثیر می گذارد به دست میآید.
درک کامل از محتوای ریسک آلودگی
عناصر زیادی برای یک رویکرد موفق در کنترل میکروبیولوژیکی وجود دارد.
ارزیابی خطر کیفیت باید بر اساس دانش علمی باشد.
داشتن درک خوب از میکرو فلور موجود در محیط حیاتی است.
آلودگی میتواند از منابع مختلفی (به عنوان مثال پرسنل، مواد، تجهیزات، هوا و محیط اطراف) ناشی شود.
این مهم است که بتوانیم این ارگانیسم های غالب در محیط را به طور دقیق شناسایی کنیم تا احتمال بقای آنها یا احتمال تولید سموم را ارزیابی کنیم.
به عنوان بخشی از ارزیابی خطر، پتانسیل ایجاد آلودگی محصول یا آسیب رساندن به بیمار باید ارزیابی شود.
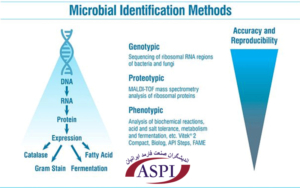
راههای زیادی برای شناسایی میکروارگانیسمهای جدا شده از محیطهای تمیز (مانند رنگآمیزی گرم، فنوتیپی، ژنوتیپی و غیره) وجود دارد.
همچنین مشخص شده است که روش رنگ آمیزی گرم یکی از شایع ترین علل شناسایی نادرست باکتری ها است.
به طور کلی 2 واکنش رنگ آمیزی گرم مشاهده شده از سویه باکتری همیشه با نوع گرم آن و مراحل متعدد و زمان های کنترل شده مورد نیاز مطابقت ندارد.
این یعنی احتمال خطای تحلیلگر و همچنین تفسیر کاربر از نتیجه وجود دارد.
فرایند سنتی و قدیمی
این فرایند سنتی و قدیمی پتانسیل ارائه نتایج نادرست را دارد و هماهنگی با الزامات مربوط به یکپارچگی دادهها دشوار است.
با توجه به اینکه کاربرد رنگ آمیزی گرم اولین گام در بسیاری از شناسایی های فنوتیپی است، میتواند منجر به نتایج اشتباه از این سیستم ها شود.
روش های مختلف شناسایی سطوح مختلفی از دقت دارند. به عنوان مثال، مدتهاست که تشخیص داده شده است روشهای ژنوتیپی دقیقتر از روشهای فنوتیپی هستند.
این روشها مناطق حفاظتشده DNA را با هم مقایسه میکنند (مانند 16S برای باکتری).
با این حال، روشهای ژنوتیپی زمانبر و گرانتر هستند و ممکن است برای نمونههای غیر بحرانی به دقت بالاتری نیاز نباشد.
اما همچنان مهم است که شناسایی دقیقی داشته باشید که به ارزیابی ریسک، روند و تحقیقات آتی کمک کند.
در سالهای اخیر، شناسایی میکروبی یونیزاسیون دفع لیزر با کمک ماتریکس امکان شناسایی سریعتر و مقرون به صرفهتر را فراهم کرده است.
در حالی که این فناوری به اندازه توالی یابی دقیق نیست، به دلیل تجزیه و تحلیل پروتئین های ریبوزومی که به DNA ارگانیسم نزدیک تر هستند، به جای تجزیه و تحلیل واکنش های بیوشیمیایی (مانند تخمیر، اسید) پتانسیل آن را دارد که بسیار دقیق تر از روش های فنوتیپی باشد.
دردسرهای ناشی از اقدامات اشتباه
هنگامی که احتمال شناسایی نادرست وجود دارد، هرگونه اقدام اصلاحی بعدی ممکن است مشکل را برطرف نکند.
مشکلات همچنان رخ خواهند داد. به طور مشابه، نرخ بالای ایزوله های ناشناس ارزیابی ریسک های خاص را دشوارتر می کند.
همانطور که در معرفی استاندارد جدید ذکر شد، باید یک سیستم رسمی کنترل میکروبیولوژیکی وجود داشته باشد که آلودگی را به طور مداوم شناسایی، کنترل و نظارت کند.
این یک فرآیند بهبود مستمر است و برنامه های نظارتی باید بر اساس نتایج داده های پایش بررسی و بازنگری شوند.
روش شناسایی هر گونه آلودگی تنها بخش کوچکی از فرآیند است.
با این وجود روشی بسیار مهم است زیرا شناسایی ایجاد شده ارزیابی ریسک و اقدامات بعدی را تعیین میکند.
یکی از جنبههایی که اغلب نادیده گرفته میشود، کتابخانه یا پایگاه دادهای است که سیستم برای تولید شناسه به آن متکی است.
این موضوع در فارماکوپه ها بیان شده است. به عنوان مثال، فصل 5.1.6 فارماکوپه اروپایی (10.0) بیان می کند:
پایگاه های داده بخشی از سیستم هستند و در اعتبار سنجی اولیه گنجانده شده اند.
از آنجایی که روشهای شناسایی به استفاده از پایگاههای اطلاعاتی بستگی دارد، میزان پوشش پایگاه داده با توجه به طیف میکروارگانیسمهای غالب در محیط باید در طول اعتبارسنجی در نظر گرفته شود.
سیستمهای شناسایی میکروبیولوژیکی مبتنی بر روشهای تحلیلی متفاوتی هستند.
البته وقتی یک سیستم شناسایی پوشش کافی ندارد، همیشه منجر به “عدم شناسایی” نمیشود.
مهم میزان دقت است و کاربران آزمایشگاهی باید در کمال سلامت و دقت موارد را بررسی کنند.
بسیاری از سیستمهای تجاری موجود برای رسیدگی به کاربردهای بالینی و تمرکز بر گونههای مرتبط بالینی در کتابخانهها و بایگانی خود توسعه داده شدهاند.
ضرورت ارزیابی دقیق
درک انواع ارگانیسم های موجود برای ارزیابی دقیق خطر برای محصول یا بیمار ضروری است.
آلودگی میکروبیولوژیک اتاق تمیز میتواند تمام سرمایه یک مدیر را به باد بدهد.
این یک خطر جدی است و جدا از بعد اقتصادی بعد سلامت و حقوقی نیز خواهد داشت.
همیشه ردیابی منبع احتمالی آلاینده آسان تر است.
امکان بازبینی پایگاه داده از نتایج قبلی به کاربران امکان می دهد تعیین کنند که چگونه آلاینده ممکن است وارد یک منطقه بحرانی شده باشد.
گونه های مختلف مقاومت متفاوتی برابر عوامل مورد استفاده خواهند داشت.
آگاهی از گونه های موجود به درک امکان بقای برنامه پاکسازی و ضد عفونی کمک میکند.
گرما و بخار یک مرحله استریلسازی رایج است، اما بسیاری از هاگهای باکتریایی مقاومت حرارتی نشان میدهند.
شناسایی میکروبها و ارزیابی مقاومت برابر حرارت مهم است.
عامل مهم پرتودهی
آلودگی میکروبیولوژیک اتاق تمیز باید همیشه تحت مهار کاربردی و کنترل شده باشد.
مثال دیگر زمانی است که از پرتودهی به عنوان یک فرآیند استریلیزاسیون پایانی استفاده میشود.
گونههای زیادی وجود دارند که برابر تابش مقاوم هستند.
گروهی از ارگانیسمها هستند که به عنوان بسیار مقاوم در برابر تابش شناخته شدهاند.
تجزیه و تحلیل اطلاعات باید امکان اقدام پیشگیرانه را فراهم کند.
ابزاری که برای مدیریت دادهها استفاده میشود باید امکان شناسایی آسان روندها را فراهم کند.
نتیجه گیری
استاندارد جدید بر رویکرد مدیریت ریسک کیفیت که باید مبتنی بر دانش علمی باشد تاکید دارد.
شناسایی آلودگی و منابع بالقوه آن آلودگی برای نشان دادن و حفظ کنترل و در نهایت ارتباط با ایمنی بیمار ضروری است.
پایش موفقیت آمیز محیطهای پاک نه تنها مستلزم داشتن سیستمی برای تشخیص آلودگی میکروبیولوژیکی است، بلکه به سیستمی برای شناسایی دقیق، در سطح گونه، ارگانیسم های جدا شده نیاز دارد.
این امکان ارزیابی خطر ناشی از گونه های یافت شده را عرضه کرده و راهی برای ردیابی دقیق منبع احتمالی آلاینده فراهم می کند.